Giải Bài Tập Chuẩn độ Hóa Phân Tích là một kỹ năng quan trọng trong hóa học phân tích. Bài viết này sẽ cung cấp cho bạn hướng dẫn chi tiết, từ cơ bản đến nâng cao, giúp bạn nắm vững phương pháp này và tự tin giải quyết các bài tập liên quan.
 Hình ảnh minh họa quá trình chuẩn độ hóa học phân tích
Hình ảnh minh họa quá trình chuẩn độ hóa học phân tích
Chuẩn Độ Hóa Phân Tích là gì?
Chuẩn độ là một kỹ thuật phân tích định lượng được sử dụng để xác định nồng độ của một dung dịch chưa biết (chất phân tích) bằng cách cho nó phản ứng với một dung dịch có nồng độ đã biết chính xác (chất chuẩn). Quá trình này liên quan đến việc thêm từ từ dung dịch chuẩn vào dung dịch phân tích cho đến khi phản ứng hoàn toàn, được biểu thị bằng sự thay đổi màu sắc của chất chỉ thị hoặc bằng cách sử dụng các phương pháp đo lường khác. Điểm mà tại đó phản ứng hoàn toàn được gọi là điểm tương đương.
bài tập và giải nguyên lý thống kê
Các Loại Chuẩn Độ Hóa Phân Tích
Có nhiều loại chuẩn độ khác nhau, mỗi loại dựa trên một loại phản ứng hóa học cụ thể. Một số loại chuẩn độ phổ biến bao gồm:
- Chuẩn độ axit-bazơ: Xác định nồng độ của axit hoặc bazơ bằng cách sử dụng phản ứng trung hòa.
- Chuẩn độ oxy hóa-khử: Dựa trên phản ứng oxy hóa-khử giữa chất phân tích và chất chuẩn.
- Chuẩn độ kết tủa: Sử dụng phản ứng tạo kết tủa để xác định nồng độ của ion trong dung dịch.
- Chuẩn độ tạo phức: Dựa trên sự hình thành phức chất giữa chất phân tích và chất chuẩn.
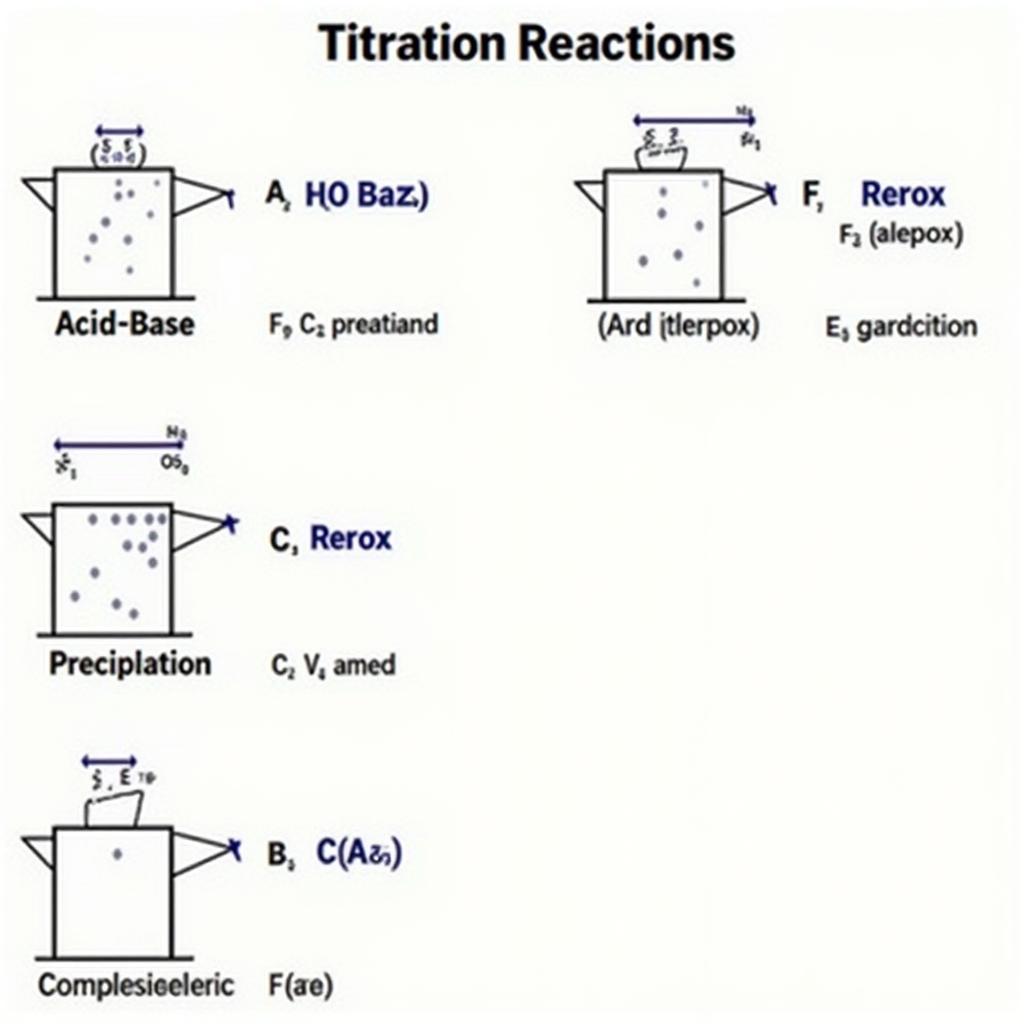 Hình ảnh minh họa các loại phản ứng chuẩn độ hóa học phân tích
Hình ảnh minh họa các loại phản ứng chuẩn độ hóa học phân tích
## Giải Bài Tập Chuẩn Độ Axit-Bazơ: Ví Dụ Minh Họa
Để hiểu rõ hơn về cách giải bài tập chuẩn độ, chúng ta hãy xem xét một ví dụ cụ thể về chuẩn độ axit-bazơ.
Bài toán: 25 ml dung dịch NaOH chưa biết nồng độ được chuẩn độ bằng dung dịch HCl 0,1M. Thể tích HCl tiêu tốn là 20 ml. Tính nồng độ của dung dịch NaOH.
Giải:
- Viết phương trình phản ứng: NaOH + HCl → NaCl + H2O
- Tính số mol HCl: n(HCl) = C(HCl) V(HCl) = 0,1M 0.02L = 0.002 mol
- Theo phương trình phản ứng, tỉ lệ mol NaOH : HCl là 1:1. Vậy n(NaOH) = n(HCl) = 0.002 mol
- Tính nồng độ NaOH: C(NaOH) = n(NaOH) / V(NaOH) = 0.002 mol / 0.025L = 0.08M
Mẹo Giải Bài Tập Chuẩn Độ Hóa Phân Tích Hiệu Quả
- Nắm vững các khái niệm cơ bản về chuẩn độ, các loại chuẩn độ và nguyên tắc hoạt động của chúng.
- Luyện tập giải nhiều bài tập với các mức độ khó khác nhau.
- Chú ý đến các đơn vị và cách chuyển đổi đơn vị.
GS. TS. Nguyễn Văn A, chuyên gia hóa học phân tích, chia sẻ: “Việc luyện tập thường xuyên là chìa khóa để thành thạo kỹ năng giải bài tập chuẩn độ. Hãy bắt đầu với những bài tập đơn giản và dần dần nâng cao độ khó.”
Kết luận
Giải bài tập chuẩn độ hóa phân tích đòi hỏi sự hiểu biết về nguyên tắc và kỹ thuật chuẩn độ. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức cần thiết để giải quyết các bài tập liên quan đến chuẩn độ hóa phân tích. Hãy tiếp tục luyện tập để nâng cao kỹ năng của mình.
FAQ
- Chuẩn độ là gì?
- Các loại chuẩn độ phổ biến là gì?
- Làm thế nào để xác định điểm tương đương trong chuẩn độ?
- Vai trò của chất chỉ thị trong chuẩn độ là gì?
- Làm thế nào để tính nồng độ của dung dịch chưa biết trong chuẩn độ?
- Những sai số thường gặp khi thực hiện chuẩn độ là gì?
- Ứng dụng của chuẩn độ trong thực tế là gì?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc xác định điểm tương đương, lựa chọn chất chỉ thị phù hợp và tính toán nồng độ dung dịch.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về giải bài tập giáo dục công dân 7 bài 7.






