Metan (CH₄) là một hydrocacbon quan trọng trong chương trình Hóa học lớp 9. Hiểu rõ tính chất và các phản ứng hóa học của metan là nền tảng để học tốt hóa học hữu cơ. Bài viết này sẽ hướng dẫn bạn Giải Bài Tập Hóa 9 Metan từ cơ bản đến nâng cao, cung cấp kiến thức vững chắc và phương pháp giải bài tập hiệu quả.
Tính Chất của Metan (CH₄)
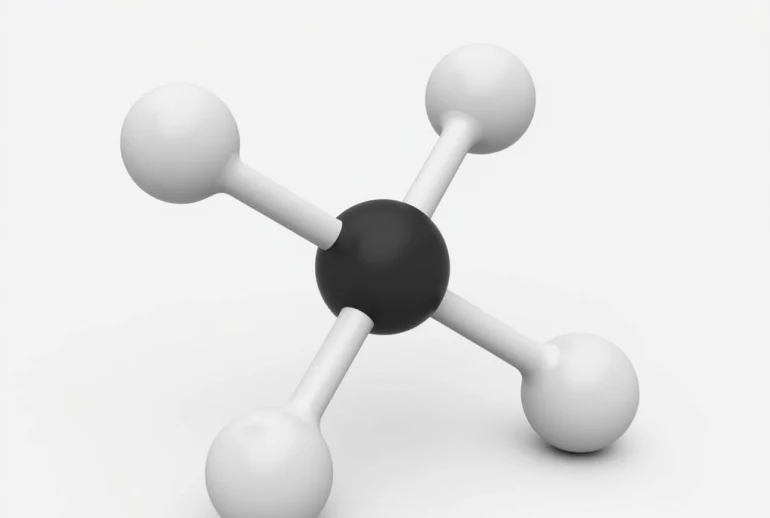
Metan là chất khí không màu, không mùi, nhẹ hơn không khí và ít tan trong nước. Đây là thành phần chính của khí thiên nhiên, biogas và khí đầm lầy. Metan có cấu tạo phân tử tứ diện đều, với nguyên tử cacbon ở tâm và bốn nguyên tử hydro ở bốn đỉnh.
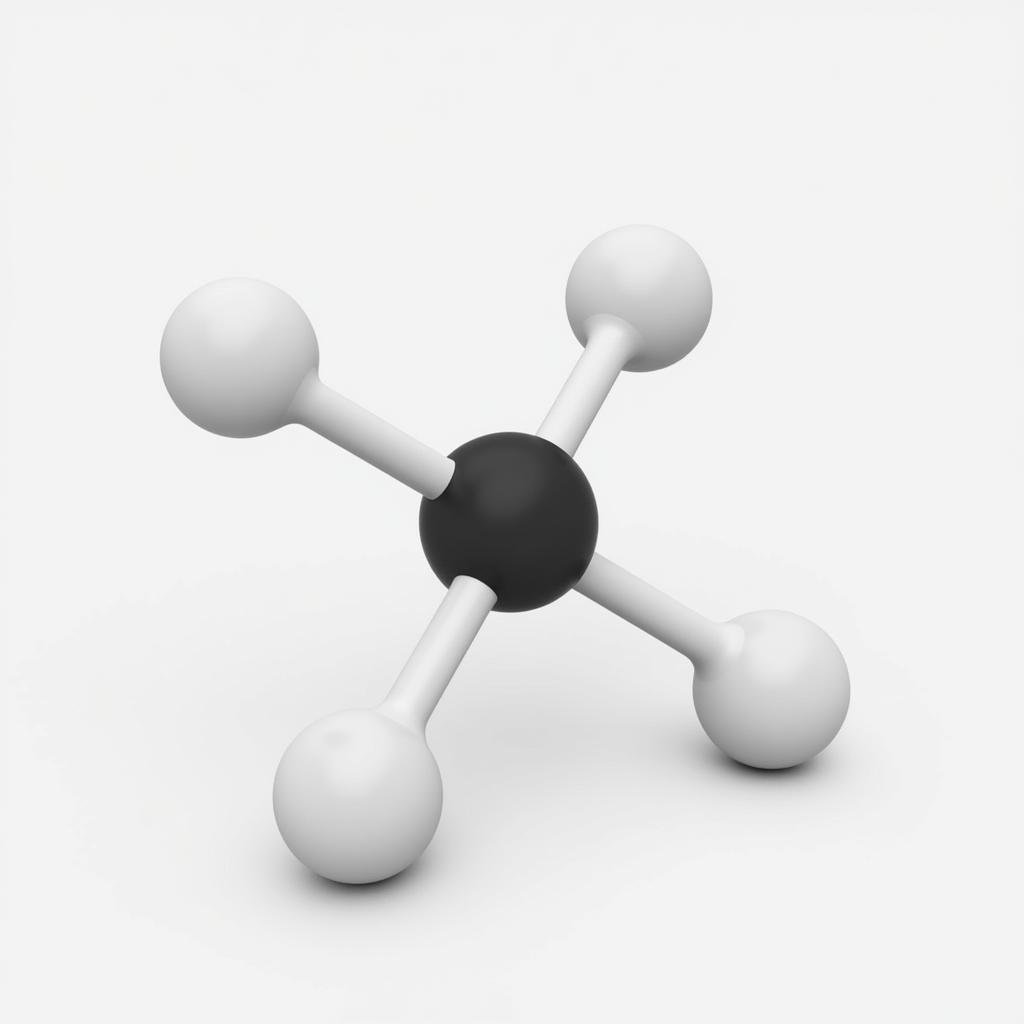 Mô hình phân tử Metan CH4
Mô hình phân tử Metan CH4
Phản ứng đặc trưng của Metan
Metan tham gia một số phản ứng hóa học quan trọng, bao gồm phản ứng cháy và phản ứng thế với clo.
Phản ứng cháy của Metan
Metan cháy trong oxi tạo ra khí cacbonic và nước, đồng thời tỏa nhiều nhiệt. Phản ứng này được biểu diễn bằng phương trình hóa học sau:
CH₄ + 2O₂ → CO₂ + 2H₂O
Phản ứng cháy của metan được ứng dụng rộng rãi trong đời sống, ví dụ như làm nhiên liệu đốt trong sinh hoạt và công nghiệp.
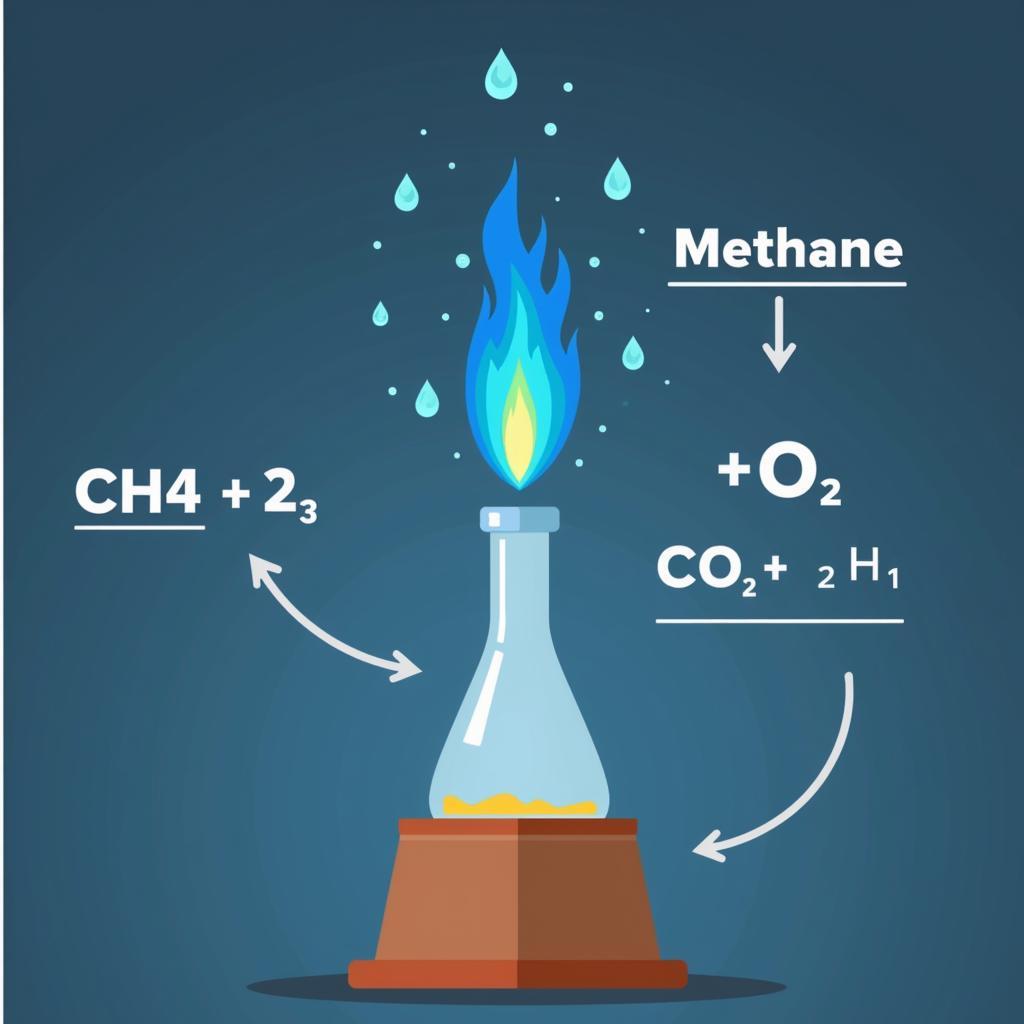 Hình ảnh minh họa phản ứng cháy của metan
Hình ảnh minh họa phản ứng cháy của metan
Phản ứng thế của Metan với Clo
Metan tác dụng với clo khi có ánh sáng khuếch tán tạo thành các sản phẩm thế. Ví dụ:
CH₄ + Cl₂ → CH₃Cl + HCl
Phản ứng này là phản ứng thế, nguyên tử hydro trong phân tử metan bị thay thế bởi nguyên tử clo. giải bài tập hóa 9 bài 36 metan sgk sẽ giúp bạn hiểu rõ hơn về phản ứng này.
Giải Bài Tập Hóa 9 Metan – Ví dụ
Để giúp bạn nắm vững kiến thức về metan, chúng ta sẽ cùng giải một số bài tập ví dụ.
Ví dụ 1: Tính khối lượng khí metan cần dùng để đốt cháy hoàn toàn tạo ra 8,8 gam khí CO₂.
Lời giải:
-
Viết phương trình phản ứng: CH₄ + 2O₂ → CO₂ + 2H₂O
-
Tính số mol CO₂: n(CO₂) = m/M = 8,8/44 = 0,2 mol
-
Theo phương trình phản ứng, tỉ lệ mol giữa CH₄ và CO₂ là 1:1. Vậy n(CH₄) = n(CO₂) = 0,2 mol
-
Tính khối lượng CH₄: m(CH₄) = n x M = 0,2 x 16 = 3,2 gam.
Ví dụ 2: Cho 11,2 lít metan (đktc) phản ứng hoàn toàn với clo. Tính thể tích khí HCl thu được (đktc).
Lời giải:
-
Viết phương trình phản ứng: CH₄ + Cl₂ → CH₃Cl + HCl
-
Tính số mol CH₄: n(CH₄) = V/22,4 = 11,2/22,4 = 0,5 mol
-
Theo phương trình phản ứng, tỉ lệ mol giữa CH₄ và HCl là 1:1. Vậy n(HCl) = n(CH₄) = 0,5 mol
-
Tính thể tích HCl: V(HCl) = n x 22,4 = 0,5 x 22,4 = 11,2 lít. giải bài tập hóa lớp 9 bài 36 metan cung cấp thêm nhiều bài tập tương tự.
 Hình ảnh minh họa bài tập hóa học về metan
Hình ảnh minh họa bài tập hóa học về metan
Kết luận
Giải bài tập hóa 9 metan đòi hỏi sự hiểu biết về tính chất và phản ứng của metan. Bài viết này đã cung cấp cho bạn những kiến thức cơ bản và phương pháp giải bài tập hiệu quả. Hy vọng bạn sẽ áp dụng thành công vào việc học tập. giải bài 36 mêtan sẽ là nguồn tài liệu hữu ích cho bạn.
FAQ
- Metan là gì?
- Tính chất vật lý của metan là gì?
- Phản ứng đặc trưng của metan là gì?
- Làm thế nào để tính toán khối lượng metan trong phản ứng cháy?
- Metan có ứng dụng gì trong đời sống?
- Làm thế nào để học tốt hóa học về metan?
- Nguồn tài liệu nào hỗ trợ giải bài tập hóa 9 về metan?
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về bài tập kt vi mô có lời giải hoặc giải toán lớp 9 sách bài tập trên BaDaoVl.
Kêu gọi hành động:
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Tòa nhà Etown Central, 11 Đoàn Văn Bơ, Quận 4, TP. Hồ Chí Minh, Việt Nam.. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.