Nhóm halogen, một chủ đề quan trọng trong chương trình Hóa học, thường gây khó khăn cho học sinh với nhiều dạng bài tập đa dạng. Giải Bài Tập Khái Quát Về Nhóm Halogen đòi hỏi sự nắm vững kiến thức lý thuyết và kỹ thuật giải bài. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quát về nhóm halogen, kèm theo hướng dẫn giải các dạng bài tập thường gặp, giúp bạn chinh phục chủ đề này một cách dễ dàng.
giải bài tập hóa lớp 11 bài 16
Tính chất vật lý của Halogen
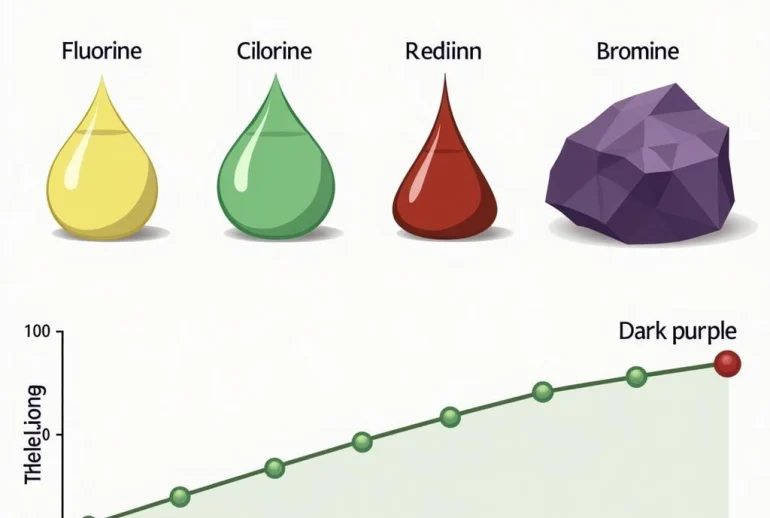
Nhóm halogen (nhóm VIIA) bao gồm các nguyên tố: Flo (F), Clo (Cl), Brom (Br), Iot (I) và Astat (At). Chúng tồn tại ở cả ba trạng thái rắn, lỏng và khí ở điều kiện thường. Từ flo đến iot, màu sắc đậm dần và nhiệt độ nóng chảy, nhiệt độ sôi tăng dần.
Xu hướng biến đổi tính chất vật lý
- Trạng thái: F2 (khí), Cl2 (khí), Br2 (lỏng), I2 (rắn).
- Màu sắc: F2 (vàng lục nhạt), Cl2 (vàng lục), Br2 (nâu đỏ), I2 (tím đen).
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần từ F2 đến I2.
 Tính chất vật lý của nhóm halogen
Tính chất vật lý của nhóm halogen
Tính chất hóa học của Halogen
Halogen là nhóm nguyên tố phi kim điển hình, có tính oxi hóa mạnh. Tính oxi hóa giảm dần từ flo đến iot.
Phản ứng với kim loại
Halogen phản ứng mạnh với hầu hết kim loại tạo thành muối halogenua. Ví dụ:
2Na + Cl2 → 2NaCl
Phản ứng với hidro
Halogen phản ứng với hidro tạo thành hidro halogenua. Ví dụ:
H2 + Cl2 → 2HCl
Phản ứng với nước
Flo phản ứng mãnh liệt với nước. Clo, brom và iot phản ứng chậm hơn, tạo ra hỗn hợp axit. Ví dụ:
Cl2 + H2O ⇌ HCl + HClO
Giải Bài Tập Khái Quát Về Nhóm Halogen – Các dạng bài tập thường gặp
Dạng 1: So sánh tính chất của các halogen
Để so sánh tính chất, cần nhớ tính oxi hóa giảm dần từ F2 đến I2.
Ví dụ: So sánh tính oxi hóa của Cl2 và Br2.
Vì Cl2 đứng trước Br2 trong bảng tuần hoàn nên Cl2 có tính oxi hóa mạnh hơn Br2.
Dạng 2: Viết phương trình phản ứng
Cần nắm vững các tính chất hóa học đặc trưng của halogen để viết phương trình phản ứng.
Ví dụ: Viết phương trình phản ứng giữa Cl2 và dung dịch NaOH.
Cl2 + 2NaOH → NaCl + NaClO + H2O
các dạng bài tập chương halogen có lời giải
Dạng 3: Bài toán định lượng
Áp dụng định luật bảo toàn khối lượng và các công thức tính toán để giải bài toán.
Ví dụ: Cho 1,12 lít Cl2 (đktc) tác dụng với dung dịch KI dư. Tính khối lượng I2 sinh ra.
Theo GS. TS. Nguyễn Văn A, chuyên gia Hóa học: “Việc luyện tập thường xuyên các dạng bài tập định lượng sẽ giúp học sinh nắm vững kiến thức và áp dụng thành thạo các công thức tính toán.”
 Bài toán định lượng halogen
Bài toán định lượng halogen
Kết luận
Giải bài tập khái quát về nhóm halogen yêu cầu sự hiểu biết về tính chất vật lý, hóa học và kỹ năng vận dụng vào các dạng bài tập. Hy vọng bài viết này đã cung cấp cho bạn kiến thức cần thiết để tự tin giải quyết các bài tập liên quan đến nhóm halogen.
giải bài tập hóa học lớp 11 bài 29 anken
FAQ
- Tại sao tính oxi hóa của halogen giảm dần từ F2 đến I2?
- Halogen có phản ứng với nước như thế nào?
- Flo có những tính chất đặc biệt gì so với các halogen khác?
- Làm thế nào để phân biệt các halogen trong dung dịch?
- Ứng dụng của halogen trong đời sống là gì?
- Làm thế nào để học tốt chương Halogen?
- Có những nguồn tài liệu nào hỗ trợ học tập về Halogen?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc xác định sản phẩm của phản ứng giữa halogen với các chất khác, đặc biệt là phản ứng với nước và dung dịch kiềm. Việc phân biệt các halogen trong dung dịch cũng là một vấn đề thường gặp.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các bài tập liên quan đến halogen tại giải bài tập hóa lớp 11 bài 16. Ngoài ra, website còn cung cấp nhiều bài viết hữu ích về các chủ đề khác trong chương trình Hóa học.