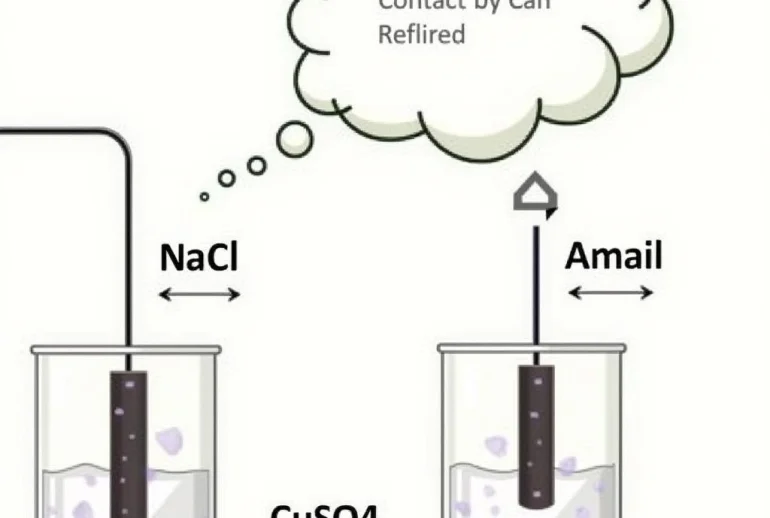
Điện phân dung dịch NaCl và CuSO4 là một phần quan trọng trong chương trình Hóa học, thường xuất hiện trong các bài tập từ cơ bản đến nâng cao. Bài viết này sẽ hướng dẫn bạn cách giải bài tập điện phân NaCl và CuSO4 chi tiết, từ lý thuyết cơ bản đến các dạng bài tập thường gặp.
Điện phân dung dịch NaCl
NaCl khi hòa tan trong nước phân ly thành các ion Na+ và Cl-. Quá trình điện phân dung dịch NaCl thực chất là quá trình điện phân nước, do thế điện phân của nước nhỏ hơn so với ion Na+.
- Tại Catot (-): 2H₂O + 2e → H₂ + 2OH⁻ (Khí H₂ bay lên)
- Tại Anot (+): 2Cl⁻ → Cl₂ + 2e (Khí Cl₂ bay lên)
Dung dịch sau điện phân chứa NaOH, do sự xuất hiện của ion OH⁻ ở catot.
Điện phân dung dịch CuSO4
CuSO4 khi hòa tan trong nước phân ly thành các ion Cu²⁺ và SO₄²⁻. Quá trình điện phân dung dịch CuSO4 diễn ra như sau:
- Tại Catot (-): Cu²⁺ + 2e → Cu (Kim loại Cu bám vào catot)
- Tại Anot (+): 2H₂O → O₂ + 4H⁺ + 4e (Khí O₂ bay lên)
Dung dịch sau điện phân chứa H₂SO₄ do sự xuất hiện của ion H⁺ ở anot.
Các dạng bài tập điện phân NaCl và CuSO4
Dạng 1: Tính khối lượng chất thoát ra ở điện cực
Bài toán yêu cầu tính khối lượng khí thoát ra ở anot hoặc catot, hoặc khối lượng kim loại bám vào điện cực. Để giải, ta sử dụng định luật Faraday: m = (AIt)/nF.
- Ví dụ: Điện phân dung dịch CuSO4 với cường độ dòng điện I = 2A trong thời gian t = 30 phút. Tính khối lượng đồng bám vào catot. (Cho Cu = 64, F = 96500).
Giải:
Áp dụng công thức Faraday: m = (AIt)/nF = (64 2 30 60) / (2 96500) ≈ 1.19g.
Dạng 2: Xác định pH dung dịch sau điện phân
Đối với dung dịch NaCl, sau điện phân dung dịch có tính bazơ do sự xuất hiện của NaOH. Đối với dung dịch CuSO4, dung dịch sau điện phân có tính axit do sự xuất hiện của H2SO4. Ta cần tính nồng độ OH⁻ hoặc H⁺ để tính pH.
Dạng 3: Điện phân hỗn hợp dung dịch
Bài toán này phức tạp hơn, cần xem xét thứ tự điện phân của các ion trong dung dịch.
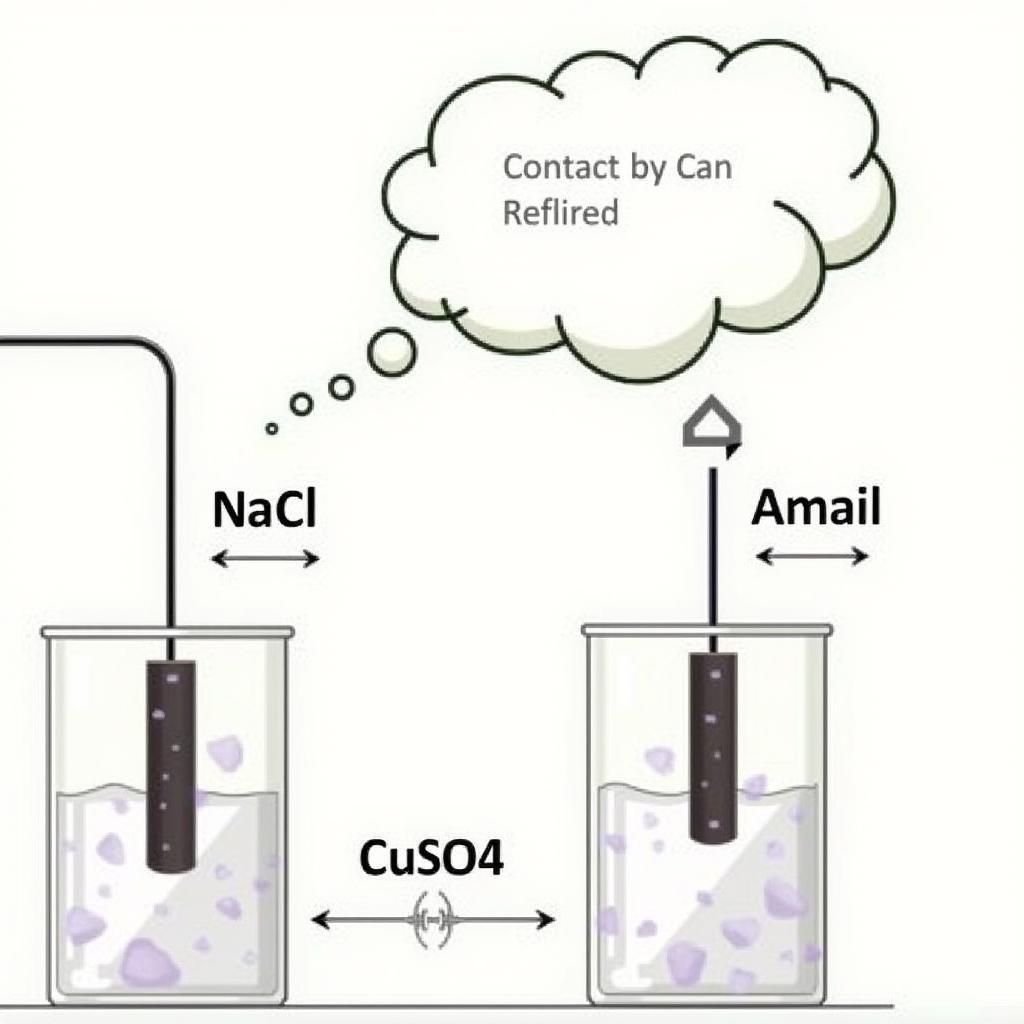 Bài tập điện phân hỗn hợp dung dịch
Bài tập điện phân hỗn hợp dung dịch
Kết luận
Việc nắm vững cách giải bài tập điện phân NaCl và CuSO4 là rất quan trọng. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức cần thiết để giải quyết các bài tập liên quan đến điện phân NaCl và CuSO4.
FAQ
- Định luật Faraday là gì?
- Tại sao điện phân dung dịch NaCl lại thu được NaOH?
- Tại sao điện phân dung dịch CuSO4 lại thu được H2SO4?
- Thứ tự điện phân của các ion trong dung dịch hỗn hợp được xác định như thế nào?
- Làm thế nào để tính pH dung dịch sau điện phân?
- Ứng dụng của điện phân trong thực tế là gì?
- Sự khác nhau giữa điện phân dung dịch và điện phân nóng chảy là gì?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc xác định sản phẩm của phản ứng điện phân, đặc biệt là với dung dịch hỗn hợp. Việc áp dụng định luật Faraday để tính toán khối lượng chất cũng là một vấn đề thường gặp.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các phản ứng oxi hóa khử, cân bằng phương trình hóa học, và các bài tập hóa học khác trên website của chúng tôi.