Đốt cháy ankan và anken là dạng bài tập phổ biến trong chương trình Hóa học lớp 9 và 11. Nắm vững Cách Giải Bài Tập đốt Cháy Ankan Và Anken sẽ giúp bạn đạt điểm cao trong các kỳ thi. Bài viết này cung cấp hướng dẫn chi tiết về cách giải bài tập đốt cháy ankan và anken, từ cơ bản đến nâng cao.
Phương Pháp Giải Bài Tập Đốt Cháy Ankan
Ankan là hidrocacbon no, chỉ chứa liên kết đơn C-C. Khi đốt cháy hoàn toàn ankan, sản phẩm thu được là CO2 và H2O.
- Viết phương trình phản ứng đốt cháy: CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
- Lập hệ phương trình dựa trên dữ kiện đề bài: Thường đề bài sẽ cho khối lượng hoặc thể tích của ankan và sản phẩm cháy. Dựa vào phương trình phản ứng và các định luật bảo toàn khối lượng, bảo toàn nguyên tố, ta lập hệ phương trình để tìm số mol hoặc khối lượng các chất.
- Giải hệ phương trình và tìm kết quả: Sau khi giải hệ phương trình, ta sẽ tìm được giá trị của n (số nguyên tử cacbon trong ankan) hoặc các đại lượng khác theo yêu cầu của đề bài.
Ví dụ: Đốt cháy hoàn toàn 2,9 gam ankan A thu được 4,48 lít CO2 (đktc). Xác định công thức phân tử của A.
Phương Pháp Giải Bài Tập Đốt Cháy Anken
Anken là hidrocacbon không no, chứa một liên kết đôi C=C. Tương tự như ankan, sản phẩm cháy hoàn toàn của anken cũng là CO2 và H2O.
- Viết phương trình phản ứng đốt cháy: CnH2n + 3n/2 O2 → nCO2 + nH2O
- Lập hệ phương trình dựa trên dữ kiện đề bài: Dựa vào dữ kiện đề bài (khối lượng, thể tích) và phương trình phản ứng, kết hợp với các định luật bảo toàn, ta lập hệ phương trình.
- Giải hệ phương trình và tìm kết quả: Giải hệ phương trình để tìm ra giá trị của n hoặc các đại lượng cần tìm khác.
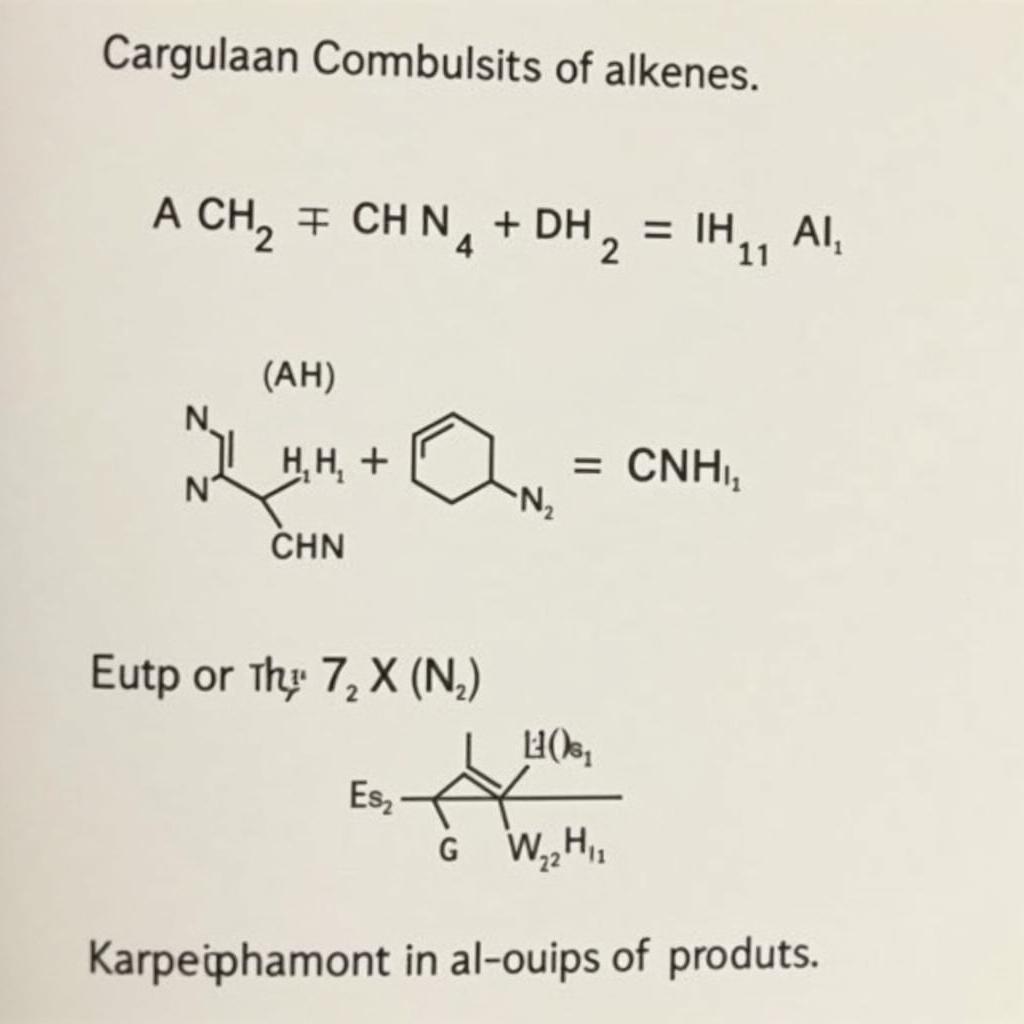 Phương trình đốt cháy anken tổng quát
Phương trình đốt cháy anken tổng quát
Ví dụ: Đốt cháy hoàn toàn 5,6 lít anken B (đktc) thu được 16,8 lít CO2 (đktc). Xác định công thức phân tử của B.
Phân Biệt Cách Giải Bài Tập Đốt Cháy Ankan và Anken
Điểm khác biệt chính giữa cách giải bài tập đốt cháy ankan và anken nằm ở phương trình phản ứng. Do đó, việc xác định đúng loại hidrocacbon là bước quan trọng. Một số mẹo nhỏ giúp phân biệt ankan và anken:
- Số mol CO2 và H2O: Đối với ankan, số mol CO2 luôn nhỏ hơn số mol H2O. Đối với anken, số mol CO2 bằng số mol H2O.
- Dữ kiện về phản ứng cộng: Anken có thể tham gia phản ứng cộng với Br2, H2, … Nếu đề bài cung cấp thông tin về phản ứng cộng, ta có thể kết luận đó là anken.
giải bài tập 1 sgk trang 119 hoá 9
Bài Tập Đốt Cháy Ankan và Anken Nâng Cao
 Bài tập đốt cháy nâng cao
Bài tập đốt cháy nâng cao
Các bài tập nâng cao thường kết hợp đốt cháy với các dạng bài tập khác như xác định công thức phân tử, tính hiệu suất phản ứng, bài toán hỗn hợp ankan và anken…
GS. TS. Nguyễn Văn A, chuyên gia Hóa học hàng đầu Việt Nam, chia sẻ: “Việc thành thạo cách giải bài tập đốt cháy ankan và anken là nền tảng quan trọng để học tốt Hóa học hữu cơ.”
PGS. TS. Trần Thị B, giảng viên Đại học Sư Phạm Hà Nội, bổ sung: “Khi làm bài tập đốt cháy, học sinh cần chú ý đến việc cân bằng phương trình phản ứng và áp dụng đúng các định luật bảo toàn.”
cách giải bài toán oxi hóa khử
Kết luận
Bài viết đã trình bày cách giải bài tập đốt cháy ankan và anken, từ cơ bản đến nâng cao. Hy vọng bài viết này sẽ giúp bạn tự tin hơn khi giải quyết các bài tập liên quan đến chủ đề này. Nắm vững cách giải bài tập đốt cháy ankan và anken không chỉ giúp bạn đạt điểm cao trong các kỳ thi mà còn giúp bạn xây dựng nền tảng vững chắc cho việc học Hóa học hữu cơ sau này.
FAQ
- Sản phẩm cháy của ankan và anken là gì? (CO2 và H2O)
- Làm thế nào để phân biệt ankan và anken? (Dựa vào số mol CO2 và H2O, hoặc phản ứng cộng)
- Công thức tổng quát của ankan là gì? (CnH2n+2)
- Công thức tổng quát của anken là gì? (CnH2n)
- Đốt cháy ankan và anken có tỏa nhiệt không? (Có)
- Tại sao cần cân bằng phương trình phản ứng khi giải bài tập đốt cháy? (Để đảm bảo tính chính xác của kết quả)
- Làm thế nào để tính hiệu suất phản ứng đốt cháy? (So sánh lượng sản phẩm thực tế thu được với lượng sản phẩm lý thuyết)
Bạn có thể quan tâm đến các bài viết khác:
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Tòa nhà Etown Central, 11 Đoàn Văn Bơ, Quận 4, TP. Hồ Chí Minh, Việt Nam.. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.