Cách Giải Các Dạng Bài Tập Hóa 11 Chương 1 là một trong những từ khóa được tìm kiếm nhiều nhất bởi học sinh lớp 11. Chương 1 Hóa học 11 bao gồm nhiều kiến thức quan trọng, đặt nền móng cho cả năm học, do đó việc nắm vững cách giải các dạng bài tập là vô cùng cần thiết. Bài viết này sẽ hướng dẫn chi tiết cách giải các dạng bài tập thường gặp, từ cơ bản đến nâng cao, giúp bạn tự tin chinh phục chương 1 Hóa 11.
Sự Điện Li
Sự điện li là một khái niệm nền tảng trong hóa học 11 chương 1. Hiểu rõ về sự điện li, chất điện li mạnh, yếu, axit, bazơ, muối là chìa khóa để giải quyết các bài tập liên quan.
Chất Điện Li
Chất điện li là những chất khi tan trong nước (hoặc ở trạng thái nóng chảy) phân li thành các ion. Chúng ta có chất điện li mạnh và chất điện li yếu.
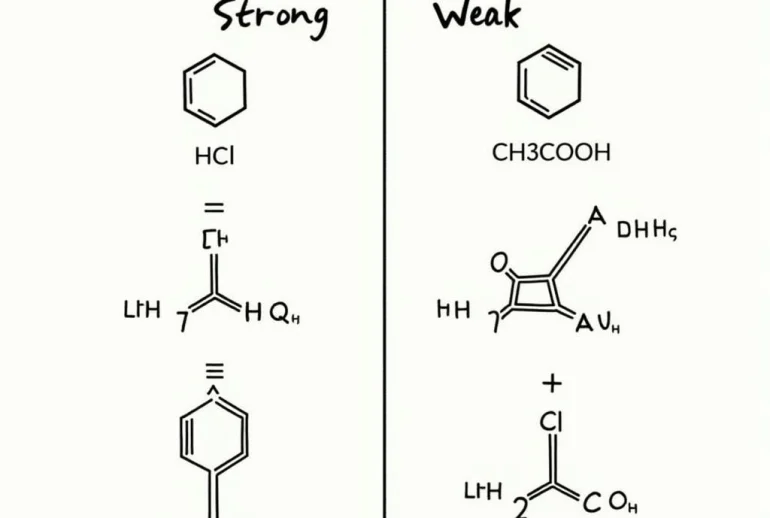
- Chất điện li mạnh: Phân li hoàn toàn thành ion. Ví dụ: HCl, NaOH, NaCl.
- Chất điện li yếu: Phân li một phần thành ion. Ví dụ: CH3COOH, NH3, H2S.
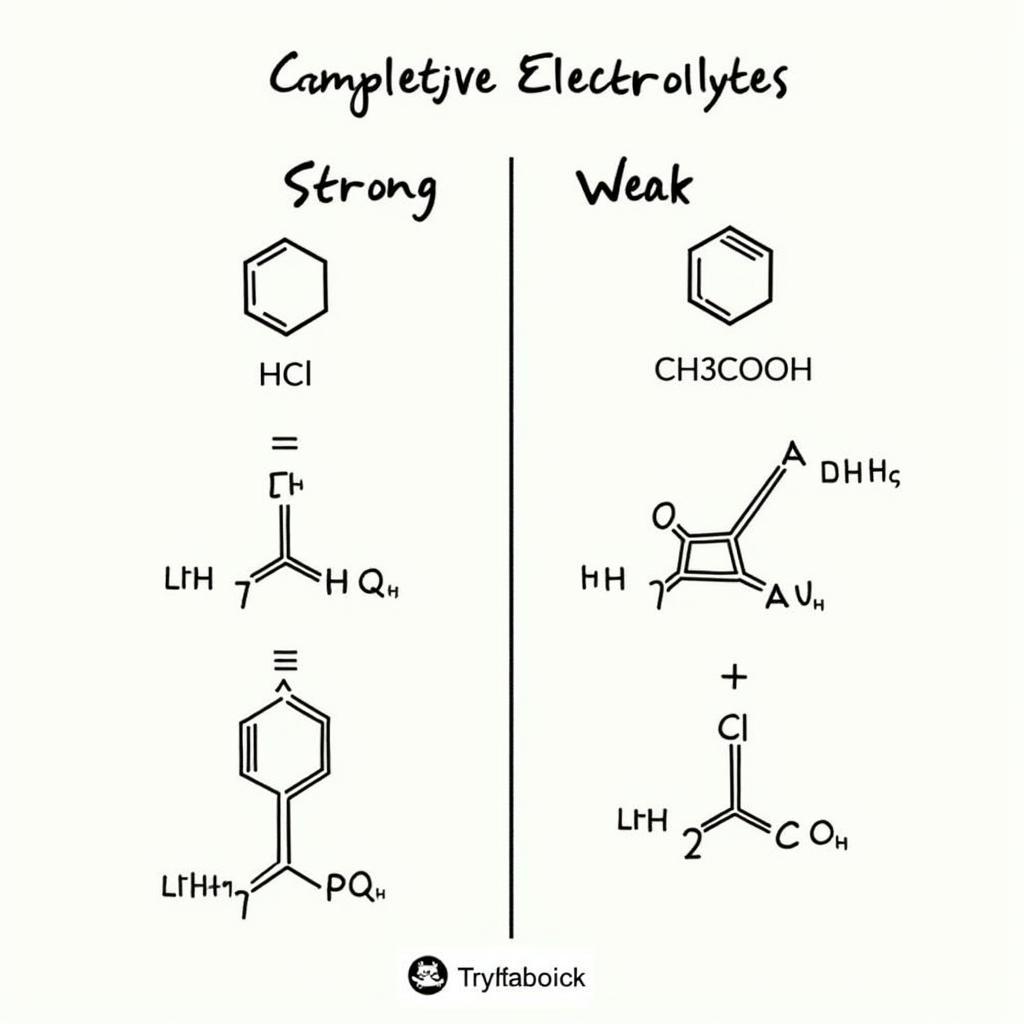 Phân loại chất điện li
Phân loại chất điện li
Axit, Bazơ, Muối
Theo thuyết Bronsted-Lowry:
- Axit: Chất cho proton (H+).
- Bazơ: Chất nhận proton (H+).
- Muối: Sản phẩm của phản ứng giữa axit và bazơ.
Việc xác định đúng chất nào là axit, bazơ, muối sẽ giúp bạn viết phương trình điện li chính xác.
pH và pOH
pH và pOH là các đại lượng dùng để đo độ axit và bazơ của dung dịch.
- pH = -lg[H+]
- pOH = -lg[OH–]
- pH + pOH = 14 (ở 25°C)
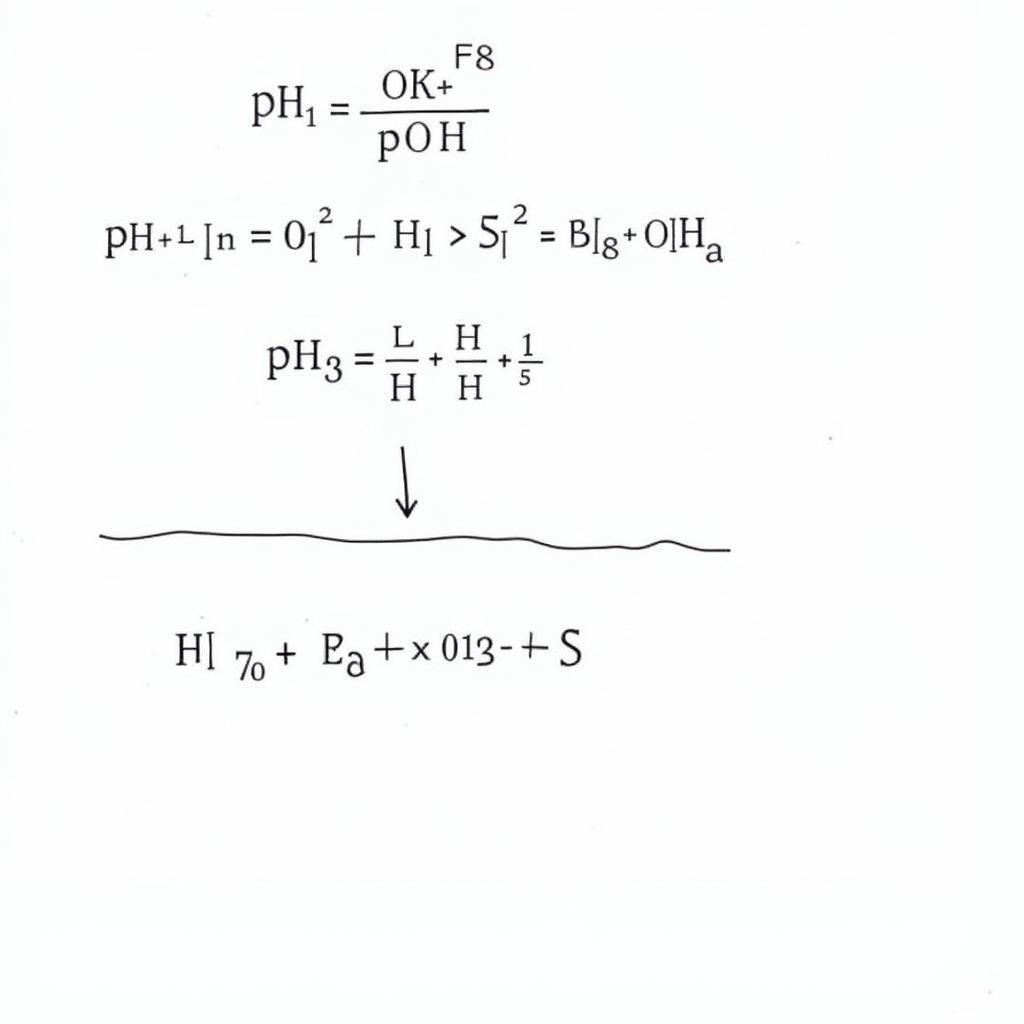 Công thức tính pH và pOH
Công thức tính pH và pOH
Cách tính pH, pOH của dung dịch axit, bazơ mạnh
Đối với axit mạnh, [H+] = nồng độ axit. Tương tự, đối với bazơ mạnh, [OH–] = nồng độ bazơ. Từ đó, ta có thể dễ dàng tính được pH và pOH.
Cách tính pH, pOH của dung dịch axit, bazơ yếu
Đối với axit, bazơ yếu, ta cần sử dụng hằng số điện li (Ka, Kb) để tính nồng độ ion H+ hoặc OH–.
Tích số ion của nước
Tích số ion của nước (Kw) là một hằng số quan trọng trong chương 1. Ở 25°C, Kw = [H+][OH–] = 10-14.
Bài tập vận dụng
Bài tập 1: Tính pH của dung dịch HCl 0.1M
Vì HCl là axit mạnh nên [H+] = 0.1M. Vậy pH = -lg(0.1) = 1.
Bài tập 2: Tính pH của dung dịch CH3COOH 0.1M biết Ka = 1.8 x 10-5
Đây là bài toán tính pH của dung dịch axit yếu.
Kết luận
Cách giải các dạng bài tập hóa 11 chương 1 đòi hỏi sự nắm vững kiến thức về sự điện li, pH, pOH và tích số ion của nước. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức cần thiết để giải quyết các bài tập một cách hiệu quả.
 Bài tập vận dụng Hóa 11 chương 1
Bài tập vận dụng Hóa 11 chương 1
FAQ
- Sự điện li là gì?
- Phân biệt chất điện li mạnh và yếu?
- Công thức tính pH và pOH là gì?
- Tích số ion của nước là gì?
- Làm sao để tính pH của dung dịch axit yếu?
- Axit, bazơ, muối theo Bronsted-Lowry là gì?
- Tại sao cần học cách giải các dạng bài tập hóa 11 chương 1?
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Bài tập về phản ứng trao đổi ion
- Bài tập về cân bằng axit-bazơ
- Bài tập về thủy phân muối
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Tòa nhà Etown Central, 11 Đoàn Văn Bơ, Quận 4, TP. Hồ Chí Minh, Việt Nam.. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.