Chuyển dịch cân bằng hóa học là một khái niệm quan trọng trong hóa học, ảnh hưởng đến hiệu suất phản ứng. Giải Bài Tập Chuyển Dịch Cân Bằng Hóa Học giúp bạn nắm vững kiến thức này. Bài viết này sẽ cung cấp cho bạn kiến thức toàn diện về cách giải các bài tập liên quan đến chuyển dịch cân bằng hóa học, từ cơ bản đến nâng cao.
Hiểu về Nguyên Lý Le Chatelier
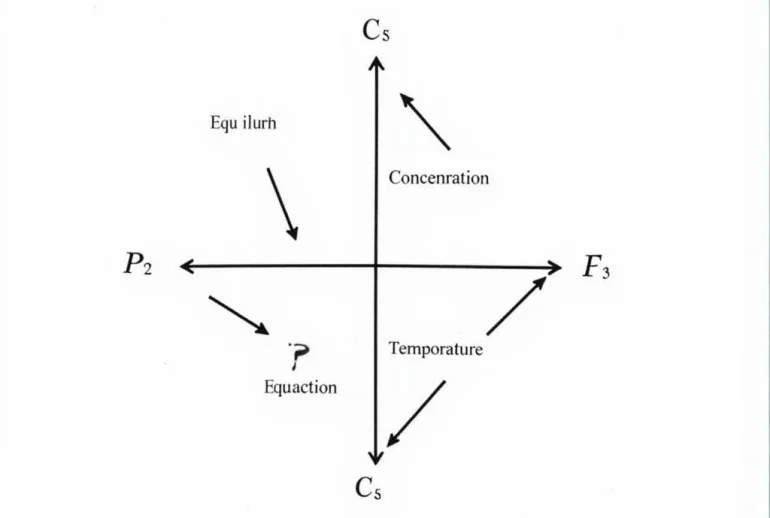
Nguyên lý Le Chatelier là nền tảng để giải quyết các bài tập chuyển dịch cân bằng. Nguyên lý này phát biểu rằng khi một hệ cân bằng chịu tác động của một yếu tố bên ngoài, hệ sẽ chuyển dịch theo chiều làm giảm tác động đó. Các yếu tố ảnh hưởng đến cân bằng hóa học bao gồm: nồng độ, áp suất, nhiệt độ và chất xúc tác. Việc thay đổi các yếu tố này sẽ khiến cân bằng phản ứng dịch chuyển sang trái hoặc sang phải để đạt được trạng thái cân bằng mới.
 Minh họa nguyên lý Le Chatelier
Minh họa nguyên lý Le Chatelier
Ảnh hưởng của Nồng Độ
Khi tăng nồng độ của một chất, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ chất đó. Ngược lại, khi giảm nồng độ của một chất, cân bằng sẽ chuyển dịch theo chiều làm tăng nồng độ chất đó.
Ảnh hưởng của Áp Suất
Áp suất chỉ ảnh hưởng đến cân bằng của các phản ứng có sự thay đổi số mol khí. Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm số mol khí. Ngược lại, khi giảm áp suất, cân bằng sẽ chuyển dịch theo chiều làm tăng số mol khí.
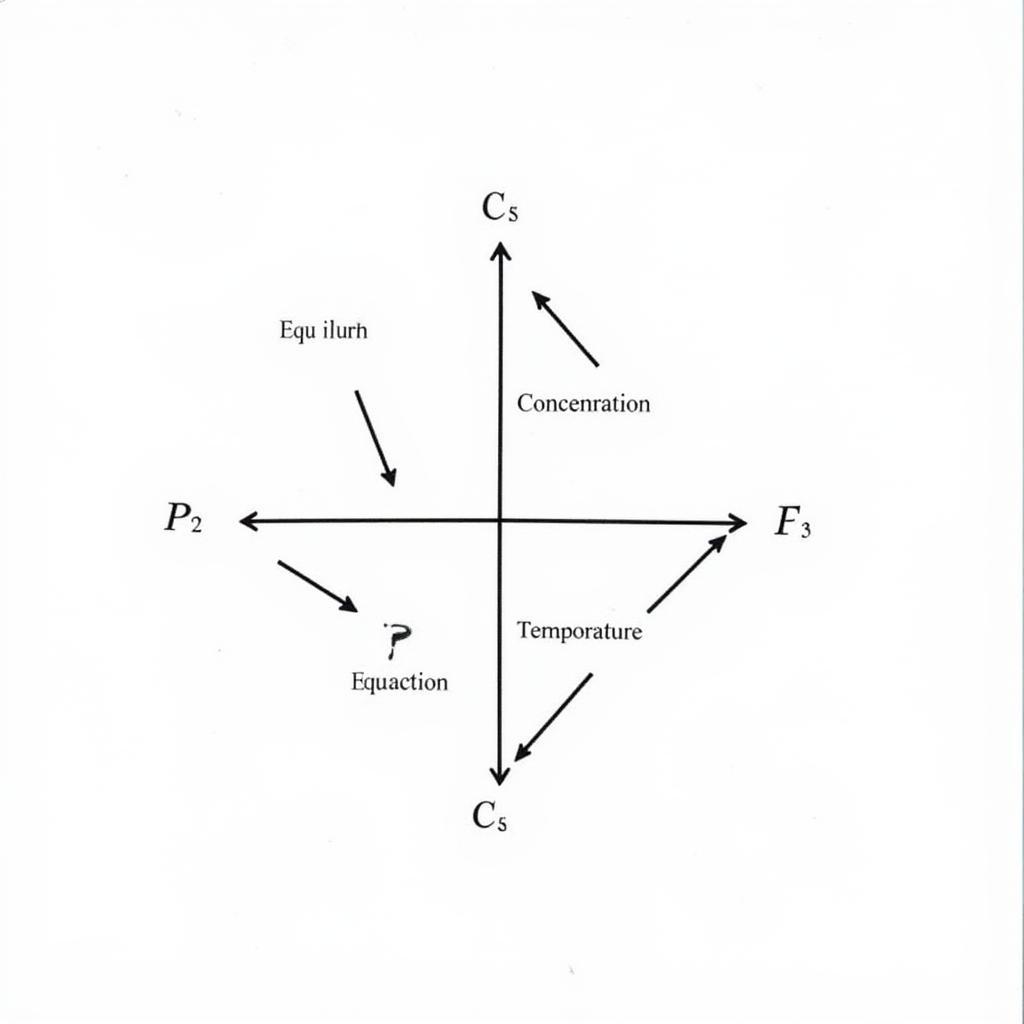
Ảnh hưởng của Nhiệt Độ
Phản ứng thuận tỏa nhiệt được coi là có nhiệt độ ở vế phải. Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thu nhiệt (ngược chiều tỏa nhiệt). Khi giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều tỏa nhiệt.
 Ảnh hưởng của nhiệt độ lên cân bằng hóa học
Ảnh hưởng của nhiệt độ lên cân bằng hóa học
Giải Bài Tập Chuyển Dịch Cân Bằng Hóa Học: Ví Dụ
Xét phản ứng tổng hợp amoniac: N2(k) + 3H2(k) ⇌ 2NH3(k) ΔH < 0
- Tăng nồng độ N2: Cân bằng chuyển dịch sang phải, tạo ra nhiều NH3 hơn.
- Giảm nồng độ H2: Cân bằng chuyển dịch sang trái, làm giảm lượng NH3.
- Tăng áp suất: Cân bằng chuyển dịch sang phải (chiều có ít mol khí hơn).
- Tăng nhiệt độ: Cân bằng chuyển dịch sang trái (phản ứng thuận tỏa nhiệt).
giải bài tập hóa 8 sgk bài 6 trang 11
Phương Pháp Giải Bài Tập Chuyển Dịch Cân Bằng Hóa Học
Để giải bài tập chuyển dịch cân bằng hóa học, bạn cần làm theo các bước sau:
- Viết phương trình phản ứng hóa học.
- Xác định chiều của phản ứng thuận và phản ứng nghịch.
- Xác định các yếu tố ảnh hưởng đến cân bằng (nồng độ, áp suất, nhiệt độ).
- Áp dụng nguyên lý Le Chatelier để dự đoán chiều chuyển dịch của cân bằng.
Phân Biệt Chuyển Dịch Cân Bằng và Chạy Hoàn Toàn
Chuyển dịch cân bằng là sự thay đổi trạng thái cân bằng khi có tác động từ bên ngoài, trong khi chạy hoàn toàn là phản ứng diễn ra theo một chiều nhất định cho đến khi một trong các chất phản ứng hết.
giải bài tập hóa 9 bài chất béo
Kết luận
Giải bài tập chuyển dịch cân bằng hóa học đòi hỏi sự hiểu biết sâu sắc về nguyên lý Le Chatelier và các yếu tố ảnh hưởng đến cân bằng. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức cần thiết để giải quyết các bài tập liên quan đến chuyển dịch cân bằng hóa học.
FAQ
- Nguyên lý Le Chatelier là gì?
- Các yếu tố nào ảnh hưởng đến cân bằng hóa học?
- Làm thế nào để dự đoán chiều chuyển dịch của cân bằng?
- Sự khác nhau giữa chuyển dịch cân bằng và chạy hoàn toàn là gì?
- Chất xúc tác có ảnh hưởng đến cân bằng hóa học không?
- Làm sao để tính hằng số cân bằng?
- Ảnh hưởng của nhiệt độ đến cân bằng hóa học như thế nào?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc xác định chiều chuyển dịch cân bằng khi thay đổi đồng thời nhiều yếu tố. Một tình huống khác là áp dụng nguyên lý Le Chatelier cho các phản ứng phức tạp.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về bài tập kế toán vốn bằng tiền có lời giải hoặc bài tập về tổng cung giải thích đúng sai.