Học tốt Hóa 10 chương 6 là chìa khóa để chinh phục kiến thức về liên kết hóa học. “Giải Bài Tập Hóa 10 Chương 6” là cụm từ khóa được nhiều học sinh tìm kiếm để nắm vững nội dung quan trọng này. Bài viết này sẽ cung cấp cho bạn những hướng dẫn chi tiết, bài giải mẫu và phương pháp học hiệu quả để giải quyết mọi bài tập Hóa 10 chương 6.
Liên Kết Hóa Học: Nền Tảng Của Mọi Chất
Liên kết hóa học là lực hút tĩnh điện giữa các nguyên tử, ion hoặc phân tử, giữ chúng lại với nhau để tạo thành các hợp chất hóa học. Hiểu rõ về liên kết hóa học sẽ giúp bạn dự đoán được tính chất của các chất và các phản ứng hóa học. Chương 6 Hóa 10 tập trung vào ba loại liên kết chính: liên kết ion, liên kết cộng hóa trị và liên kết kim loại. Việc giải bài tập hóa 10 chương 6 sẽ giúp bạn củng cố kiến thức về các loại liên kết này.
Giải Bài Tập Hóa 10 Chương 6 Về Liên Kết Ion
Liên kết ion được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Thông thường, liên kết ion xảy ra giữa kim loại và phi kim. Kim loại có xu hướng nhường electron để trở thành cation, trong khi phi kim có xu hướng nhận electron để trở thành anion. Bài tập về liên kết ion thường yêu cầu xác định loại liên kết, viết công thức hóa học và dự đoán tính chất của hợp chất.
Ví dụ: Giải thích sự hình thành liên kết ion trong NaCl.
Na (kim loại) có 1 electron lớp ngoài cùng, dễ dàng nhường 1 electron để đạt cấu hình bền vững. Cl (phi kim) có 7 electron lớp ngoài cùng, dễ dàng nhận 1 electron để đạt cấu hình bền vững. Na nhường 1 electron cho Cl, tạo thành Na+ và Cl-, hai ion này hút nhau bằng lực hút tĩnh điện tạo thành liên kết ion.
Giải Bài Tập Hóa 10 Chương 6 Về Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ electron với nhau để đạt cấu hình electron bền vững. Liên kết cộng hóa trị thường xảy ra giữa các nguyên tử phi kim. Bài tập về liên kết cộng hóa trị thường yêu cầu viết công thức Lewis, xác định dạng hình học phân tử và dự đoán tính chất của phân tử.
Ví dụ: Vẽ công thức Lewis của phân tử nước (H₂O).
Nguyên tử O có 6 electron lớp ngoài cùng, cần thêm 2 electron để đạt cấu hình bền vững. Mỗi nguyên tử H có 1 electron lớp ngoài cùng, cần thêm 1 electron. Nguyên tử O sẽ chia sẻ 1 electron với mỗi nguyên tử H, tạo thành 2 liên kết cộng hóa trị O-H.
Giải Bài Tập Hóa 10 Chương 6 Về Liên Kết Kim Loại
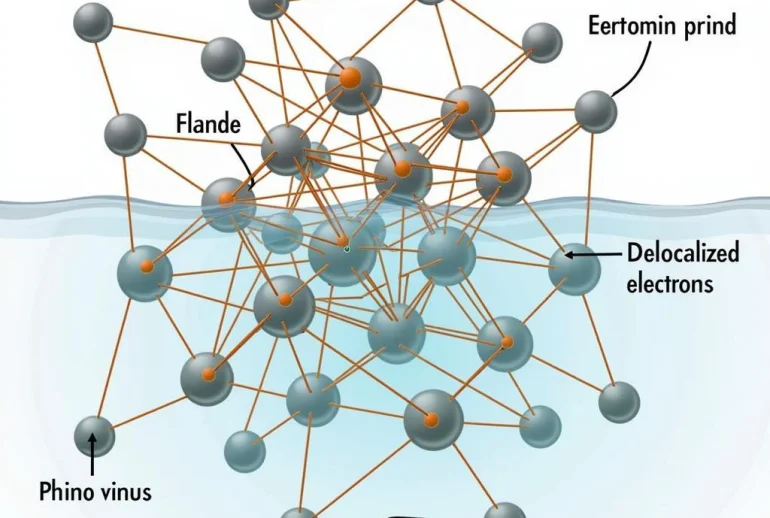
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử kim loại. Trong liên kết kim loại, các electron lớp ngoài cùng của nguyên tử kim loại di chuyển tự do trong mạng tinh thể, tạo thành “biển electron”. Tính chất của kim loại như tính dẫn điện, dẫn nhiệt và tính dẻo đều được giải thích bởi sự tồn tại của liên kết kim loại.
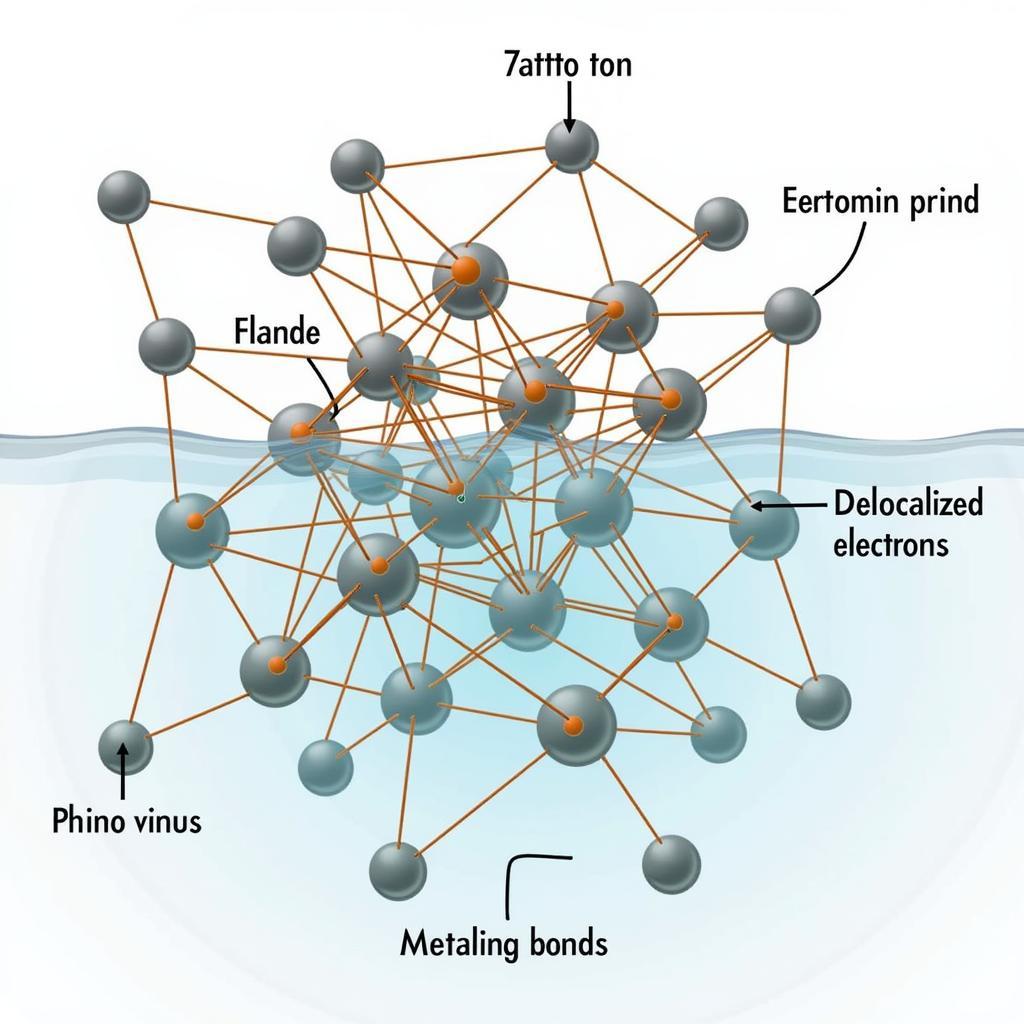 Hình ảnh minh họa liên kết kim loại
Hình ảnh minh họa liên kết kim loại
Phương Pháp Học Hiệu Quả Cho Giải Bài Tập Hóa 10 Chương 6
- Nắm vững lý thuyết: Hiểu rõ các khái niệm cơ bản về liên kết hóa học.
- Luyện tập thường xuyên: Giải nhiều bài tập từ dễ đến khó.
- Sử dụng các tài liệu tham khảo: Sách giáo khoa, sách bài tập, website học tập.
GS.TS Nguyễn Văn A, chuyên gia Hóa học, chia sẻ: “Việc giải bài tập thường xuyên là chìa khóa để nắm vững kiến thức Hóa học. Hãy bắt đầu từ những bài tập cơ bản và dần dần nâng cao độ khó.”
TS. Lê Thị B, giảng viên Đại học Sư Phạm, bổ sung: “Học sinh cần kết hợp lý thuyết với thực hành để hiểu sâu hơn về liên kết hóa học.”
Kết Luận: Chinh Phục Giải Bài Tập Hóa 10 Chương 6 Cùng BaDaoVl
Bài viết đã cung cấp cho bạn những kiến thức và phương pháp cần thiết để giải bài tập hóa 10 chương 6. Hy vọng rằng bạn sẽ tự tin hơn trong việc học tập và đạt được kết quả tốt. bài tậ oxi ozon giải chi tiết cũng là một chủ đề quan trọng trong chương trình Hóa 10. giải bài 1 trang 138 sgk hóa 10 sẽ giúp bạn củng cố kiến thức về các bài tập cơ bản. giải bài tập hóa 9 bài 22 trang 68 sẽ giúp bạn ôn tập lại kiến thức của lớp 9.
FAQ: Giải Đáp Thắc Mắc Về Giải Bài Tập Hóa 10 Chương 6
- Làm thế nào để phân biệt liên kết ion và liên kết cộng hóa trị?
- Cách xác định dạng hình học phân tử?
- Tại sao kim loại dẫn điện tốt?
- Liên kết kim loại khác gì so với liên kết ion và cộng hóa trị?
- Làm sao để học tốt Hóa 10 chương 6?
- Tài liệu nào hỗ trợ giải bài tập hóa 10 chương 6 hiệu quả?
- cách giải bài toán lớp 9 dạng chung riêng có áp dụng được cho hóa học không?
Bạn có thể tìm hiểu thêm về giải bài 56 57 58 sgk toán 8 trang 25 trên trang web của chúng tôi.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Tòa nhà Etown Central, 11 Đoàn Văn Bơ, Quận 4, TP. Hồ Chí Minh, Việt Nam.. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.