Bài viết này cung cấp lời giải chi tiết và hướng dẫn học tập cho Giải Bài Tập Hóa Học 8 Bài 43 về pha chế dung dịch. Bạn sẽ nắm vững các khái niệm, công thức tính toán và cách áp dụng vào thực tế để giải quyết các bài tập liên quan đến nồng độ phần trăm và nồng độ mol của dung dịch.
Nắm Vững Lý Thuyết Về Pha Chế Dung Dịch
Để giải bài tập hóa học 8 bài 43 hiệu quả, việc nắm vững lý thuyết là vô cùng quan trọng. Chúng ta cần hiểu rõ các khái niệm cơ bản như dung dịch, chất tan, dung môi, nồng độ phần trăm, nồng độ mol. Nồng độ phần trăm (C%) cho biết số gam chất tan có trong 100 gam dung dịch, trong khi nồng độ mol (CM) thể hiện số mol chất tan có trong 1 lít dung dịch. Công thức tính toán cho từng loại nồng độ cũng cần được ghi nhớ và áp dụng chính xác.
Hướng Dẫn Giải Bài Tập Hóa Học 8 Bài 43: Các Dạng Bài Tập Thường Gặp
Bài 43 trong chương trình hóa học 8 thường tập trung vào các dạng bài tập tính toán nồng độ dung dịch, pha loãng dung dịch, và trộn dung dịch. Dưới đây là hướng dẫn chi tiết cho từng dạng bài tập:
Dạng 1: Tính Nồng Độ Dung Dịch
- Xác định khối lượng chất tan và khối lượng dung dịch (hoặc thể tích dung dịch và số mol chất tan).
- Áp dụng công thức tính nồng độ phần trăm (C% = (m_chất tan / m_dung dịch) * 100%) hoặc nồng độ mol (CM = n_chất tan / V_dung dịch).
Dạng 2: Pha Loãng Dung Dịch
- Áp dụng công thức pha loãng: C1V1 = C2V2 (trong đó C1, V1 là nồng độ và thể tích dung dịch ban đầu, C2, V2 là nồng độ và thể tích dung dịch sau khi pha loãng).
- Tính toán thể tích dung môi cần thêm vào để đạt được nồng độ mong muốn.
giải bài tập hóa học 11 bài andehit
Dạng 3: Trộn Dung Dịch
- Tính toán tổng số mol chất tan và tổng thể tích dung dịch sau khi trộn.
- Áp dụng công thức tính nồng độ mol của dung dịch sau khi trộn.
Ví Dụ Minh Họa Giải Bài Tập Hóa Học 8 Bài 43
Để hiểu rõ hơn cách áp dụng lý thuyết vào thực tế, chúng ta hãy cùng xem xét một ví dụ: Pha chế 200g dung dịch NaCl 10%.
- Tính toán khối lượng NaCl cần dùng: m_NaCl = (C% m_dung dịch) / 100% = (10% 200g) / 100% = 20g.
- Cân 20g NaCl và cho vào cốc.
- Thêm từ từ nước vào cốc, khuấy đều cho đến khi NaCl tan hoàn toàn và đạt được tổng khối lượng dung dịch là 200g.
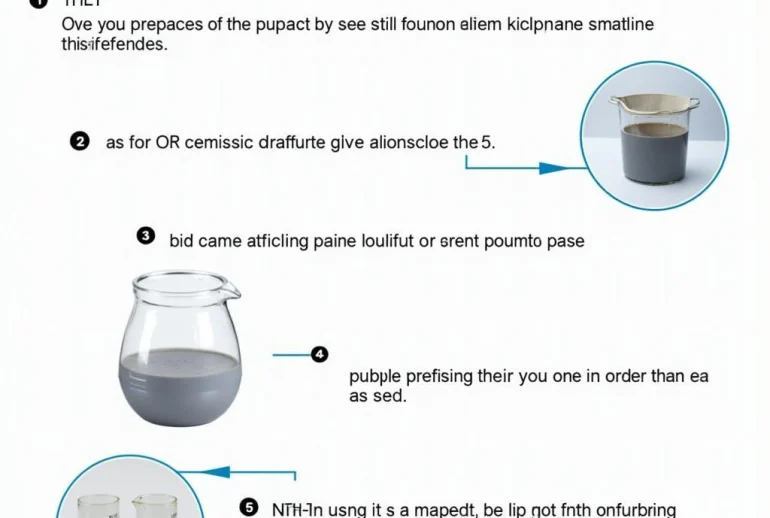
 Ví dụ Giải Bài Tập Hóa 8 Bài 43: Minh họa cách pha chế dung dịch NaCl 10% với các bước chi tiết và hình ảnh dụng cụ thí nghiệm.
Ví dụ Giải Bài Tập Hóa 8 Bài 43: Minh họa cách pha chế dung dịch NaCl 10% với các bước chi tiết và hình ảnh dụng cụ thí nghiệm.
GS.TS Nguyễn Văn A, chuyên gia hóa học hàng đầu, chia sẻ: “Việc thực hành pha chế dung dịch là rất quan trọng, giúp học sinh hiểu sâu hơn về nồng độ dung dịch và rèn luyện kỹ năng thực hành trong phòng thí nghiệm.”
bài tập về adn lớp 9 có lời giải hay
Kết luận
Giải bài tập hóa học 8 bài 43 về pha chế dung dịch đòi hỏi sự kết hợp giữa lý thuyết và thực hành. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức và kỹ năng cần thiết để giải quyết các bài tập một cách hiệu quả. Hãy luyện tập thường xuyên để nắm vững kiến thức và đạt kết quả cao trong học tập.
FAQ
- Nồng độ phần trăm là gì?
- Nồng độ mol là gì?
- Công thức tính nồng độ phần trăm là gì?
- Công thức tính nồng độ mol là gì?
- Cách pha loãng dung dịch như thế nào?
- Cách trộn dung dịch như thế nào?
- Tại sao cần phải học về pha chế dung dịch?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Tòa nhà Etown Central, 11 Đoàn Văn Bơ, Quận 4, TP. Hồ Chí Minh, Việt Nam.. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.